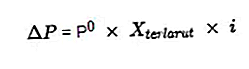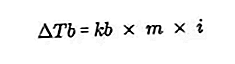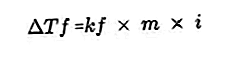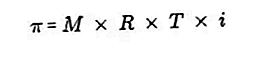Încercați să fiți atenți la ceea ce este în jurul nostru legat de chimie? Cel mai ușor este aerul pe care îl respirăm, care conține un amestec de oxigen, azot și alte gaze. Condimentele alimentare, coloranții alimentari și conservanții alimentari sunt, de asemenea, alte exemple de substanțe chimice care se află în jurul nostru. Chimia este o ramură a științelor naturii pe care o veți studia în școală care studiază diverse materiale, un exemplu este structura materiei, proprietățile materiei, forma materialului, modificările materiei, clasificarea materiei, dispunerea materiei și a energiei care însoțește aceste schimbări. Știți, nu numai matematica și fizica, ci și chimia are diferite tipuri de formule. Există multe formule chimice de la care veți învăța, de la proprietăți coligative până la reacții redox.
Cu această ocazie vom învăța diverse formule chimice, precum și exemple de probleme ale acestora, care vă vor ajuta să înțelegeți conceptele de formule chimice.
Formule chimice și exemple de probleme
Prezența formulelor în chimie este de a ajuta cercetătorii să găsească diferite tipuri de rezultate experimentale care trebuie realizate. Pentru a putea stăpâni bine această știință, trebuie să cunoașteți câteva formule chimice pe care le veți întâlni adesea atunci când studiați chimia.
Formula pentru proprietățile colective ale soluțiilor
Natura coligativă a unei soluții este natura unei soluții care nu depinde de un tip de substanță solubilă, ci depinde doar de concentrația particulelor soluției. Apoi, proprietățile coligative ale soluției constau din două tipuri de proprietăți, și anume, natura coligativă a soluției electrolitice și natura coligativă a soluției non-electrolitice.
- Proprietăți colective ale soluțiilor non-electrolitice
Deși natura coligativă implică o soluție, natura coligativă nu depinde de interacțiunea solutului și moleculelor solutului, ci de cantitatea de dizolvat dizolvată într-o soluție. Proprietățile colective constau într-o scădere a presiunii vaporilor, creșterea punctului de fierbere, scăderea punctului de îngheț și presiunea osmotică. Fiecare necesită o formulă chimică pentru a obține rezultatul.
- Ecuația căderii de presiune a aburului

Sursa: formula.co.id
- Ecuația pentru creșterea punctului de fierbere
Punctul de fierbere al unui lichid este temperatura fixă la care fierbe. La această temperatură, presiunea de vapori a lichidului are o ecuație pentru presiunea aerului din jurul său și este cauzată de evaporarea tuturor părților lichidului. Punctul de fierbere al unui lichid poate fi măsurat printr-o presiune de 1 atmosferă.
Diferența dintre punctul de fierbere al unei soluții și punctul de fierbere al unui solvent pur se numește creșterea punctului de fierbere, ecuația pentru creșterea punctului de fierbere este:

Sursa: formula.co.id
- Ecuația de scădere a punctului de îngheț
O substanță dizolvată prezentă în soluție va face punctul de îngheț al soluției mai mic decât punctul de îngheț al solventului. Ecuația de reducere a punctului de îngheț:

Sursa: formula.co.id
- Presiune osmotica
Presiunea osmotică este o forță necesară pentru a echilibra presiunea solventului de la membrana semipermiabilă prin soluție.
O membrană semipermeabilă este o membrană prin care moleculele de solvent pot trece, dar substanțele dizolvate nu pot trece. Potrivit lui Van't Hoff, la presiunea osmotică soluția este formulată după cum urmează:

Sursa: formula.co.id
- Proprietăți colective ale soluțiilor de electroliți
În concentrația proprietăților coligative ale aceleiași soluții electrolitice, are o valoare mai mare atunci când o comparăm cu proprietățile coligative ale soluției non-electrolitice. Datorită numărului mare de particule dizolvate rezultate din reacția de ionizare a soluției de electroliți care a fost formulată în factorul Van't Hoff.
Calculul proprietăților coligative ale unei soluții de electroliți va fi întotdeauna înmulțit cu factorul Van't Hoff după cum urmează:

Sursa: formula.co.id
Unele dintre formulele pentru proprietățile coligative ale altor soluții de electroliți sunt:
- Scăderea presiunii vaporilor
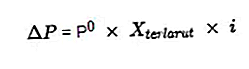
Sursa: formula.co.id
- Creșterea punctului de fierbere
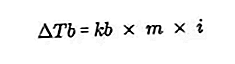
Sursa: formula.co.id
- Scăderea punctului de îngheț
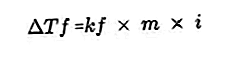
Sursa: formula.co.id
- Presiune osmotica
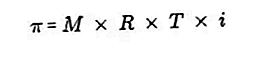
Sursa: formula.co.id
Molaritatea, Molalitatea și Formulele de fracțiune a molelor
Molaritate (M)
Molaritatea este numărul de moli dintr-o substanță dizolvată în 1 litru de soluție.

Sursa: formula.co.id
M = molaritate
Mr = masa molară a dizolvatului (g / mol)
V = volumul soluției
Molalitate (m)
Molalitatea este numărul de moli ai substanței dizolvate în 1 kg de solvent. Formula chimică este următoarea.

Sursa: formula.co.id
m = molalitate (mol / kg)
Mr = masa molară a dizolvatului (g / mol)
masa = masa solutului (g)
P = masa solventului (g)
Fracția mol
Fracția molară este o unitate de concentrație în care toate componentele soluției sunt calculate pe baza moli.

Sursa: formula.co.id
xi = numărul de alunițe
i, j, xj = fracția molară
Exemple de probleme cu formula chimică
1. Dacă presiunea osmotică a 500 ml soluție de fructoză, C6H12O6 de la 32 ° C este de 2 atm, masa fructozei dizolvate este?
Soluţie:

2. În fracția molară a soluției de uree în apă 0,2. Presiunea de vapori saturați a apei pure cu o temperatură de 20 ° C este de 17,5 mmHg. Apoi la presiunea de vapori saturați a soluției la următoarea temperatură este?
Xuree + Xapă = 1
0,2 + Xapă = 1
Xapă = 0,8
Psoluţie = Xapă x P apă
Psoluţie = 0,8 x 17,5 mmHg
Psoluţie = 14 mmHg
Acestea sunt câteva formule chimice pe care le puteți învăța pentru a vă ușura răspunsul la diferite tipuri de întrebări de chimie. Dacă credeți că aceste formule nu sunt suficiente, puteți încerca produsul PROBLEM, o soluție online ponderată, completă, pentru practicarea întrebărilor din clasa inteligentă, cum ar fi trigonometrie, limită, logaritm și multe altele. Începând de la nivelurile elementare, gimnaziale până la liceu, cu diferite discipline, precum matematică, fizică, chimie și altele. Aici puteți învăța diverse tipuri de formule completate cu exemple de probleme.
Haide, ce mai aștepți! Să încercăm exerciții de PROBLEMĂ în Smart Class chiar acum.